Bundesministerium für Gesundheit
Bekanntmachung
eines Beschlusses des Gemeinsamen Bundesausschusses
über eine Änderung der Verfahrensordnung:
Änderung zum 5. Kapitel – Feststellung zum Anteil der Prüfungsteilnehmer
im Geltungsbereich des Fünften Buches Sozialgesetzbuch (SGB V)
Der Gemeinsame Bundesausschuss hat in seiner Sitzung am 5. Dezember 2024 beschlossen, das 5. Kapitel der Verfahrensordnung in der Fassung vom 18. Dezember 2008 (BAnz. Nr. 84a vom 10. Juni 2009), die zuletzt durch die Bekanntmachung des Beschlusses vom 19. September 2024 (BAnz AT 02.01.2025 B1) geändert worden ist, wie folgt zu ändern:
Das 5. Kapitel wird wie folgt geändert:
- 1.
-
§ 9 Absatz 1 wird wie folgt geändert:
- a)
-
In Nummer 6 wird der Punkt am Ende durch ein Komma ersetzt.
- b)
-
Folgende Nummer 7 wird angefügt:
- „7.
-
Anzahl der Prüfungsteilnehmer an den klinischen Prüfungen, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben, und Gesamtzahl der Prüfungsteilnehmer.“
- 2.
-
In § 18 Absatz 2 Satz 2 werden nach den Wörtern „hinsichtlich der Angaben zu den Therapiekosten“ die Wörter „sowie der Angaben zur Anzahl der Prüfungsteilnehmer an Prüfstellen im Geltungsbereich des SGB V“ eingefügt.
- 3.
-
§ 20 Absatz 3 wird wie folgt geändert:
- a)
-
In Nummer 3 wird das Wort „und“ durch ein Komma ersetzt.
- b)
-
In Nummer 4 wird der Punkt am Ende durch das Wort „und“ ersetzt.
- c)
-
Folgende Nummer 5 wird angefügt:
- „5.
-
ob die klinischen Prüfungen des Arzneimittels zu einem relevanten Anteil im Geltungsbereich des SGB V durchgeführt wurden. Das ist der Fall, wenn der Anteil der Prüfungsteilnehmer an den klinischen Prüfungen des zu bewertenden Arzneimittels, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben, an der Gesamtzahl der Prüfungsteilnehmer mindestens fünf Prozent beträgt.“
- 4.
-
Die Anlage II.1 „Erstellung und Einreichung eines Dossiers zur Nutzenbewertung gemäß § 35a SGB V“ wird wie folgt geändert:
- a)
-
Die Tabelle „Abkürzungsverzeichnis“ wird in alphabetischer Reihenfolge um folgende Zeile ergänzt:
Abkürzung Bedeutung „SAS Statistical Analysis Software“ - b)
-
Im Abschnitt 1.1 wird in Satz 4 nach den Wörtern „Kosten der Therapie für die gesetzliche Krankenversicherung (GKV)“ das Wort „sowie“ durch ein Komma ersetzt und nach den Wörtern „Angaben zu den Anforderungen an eine qualitätsgesicherte Anwendung“ der Halbsatz: „sowie Angaben zum Anteil der Prüfungsteilnehmer an den klinischen Prüfungen zu dem Arzneimittel, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben“ eingefügt.
- c)
-
In Abschnitt 3.1 werden der Aufzählung nach den Angaben „Bewertungsbericht der Zulassungsbehörden (PDF-Dokumente; zur näheren Konkretisierung siehe Abschnitt 3.1.2)“ mit einem neuen Aufzählungszeichen folgende Angaben angefügt: „SAS-Auszüge zur Zusammenfassung der Studienrekrutierung nach Land und Prüfstelle“.
- d)
-
Abschnitt 4.1 wird unter der Überschrift „Dateien für Modul 3“ wie folgt geändert:
- aa)
-
In Satz 3 wird die Angabe „3.5“ durch „3.6“ ersetzt.
- bb)
-
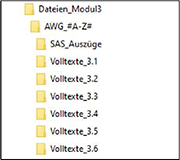
Nach Satz 3 wird der Satz „Zudem sind im Unterverzeichnis „SAS-Auszüge“ die Zusammenfassung der Studienrekrutierung nach Land und Prüfstelle für die unter Abschnitt 3.6 von Modul 3 zu treffende Feststellung zur Anzahl der Prüfungsteilnehmer an den klinischen Prüfungen zu dem Arzneimittel, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben, zu hinterlegen“ eingefügt sowie die Abbildung durch die folgende Abbildung ersetzt:„
 “
“ - cc)
-
Im Satz nach der Tabelle werden in der Aufzählung nach den Angaben „für Abschnitt 3.5: #Zitat-Nr#_#Erstautor#_#JJJJ#.pdf“ die Angaben „für Abschnitt 3.6: #Zitat-Nr#_#Erstautor#_#JJJJ#.pdf“ eingefügt.
- dd)
-
Im neuen Satz 11 werden in der Aufzählung nach den Angaben „für Abschnitt 3.5: M3#A-Z#_3-5_Referenzliste.ris“ die Angaben „für Abschnitt 3.6: M3#A-Z#_3-6_Referenzliste.ris“ eingefügt sowie nach dem Satz „Dabei ist „#A-Z#“ durch die Kodierung des Anwendungsgebiets zu ersetzen.“ der folgende Absatz angefügt:
„SAS-Auszüge
Zu jeder in Abschnitt 3.6 herangezogenen Studie ist ein SAS-Auszug zu hinterlegen, in dem die Anzahl der Studienteilnehmer aufgeschlüsselt nach Land und Prüfstelle dargestellt ist.
Die Benennung der Dateien ist wie folgt:
M3#A-Z#_#Nummer#_#Studienname#.pdf
Dabei ist „#A-Z# durch die Kodierung des Anwendungsgebiets zu ersetzen. #Nummer#“ ist durch die zugehörige Nummer in Tabelle 3-11 zu ersetzen. „#Studienname#“ ist durch die Bezeichnung der Studie zu ersetzen.“
- 5.
-
In Anlage II.3 „Modul 1 Anhang – Checkliste zur Prüfung der formalen Vollständigkeit des Dossiers“ wird in der Tabelle im Anhang 1-A.2 „Checkliste zur formalen Vollständigkeitsprüfung des Dossiers zur Nutzenbewertung, Vollständigkeit der Inhalte und Anhänge“ nach dem Abschnitt „Anforderungen an eine qualitätsgesicherte Anwendung“ folgender Abschnitt eingefügt:
Thema
ModulAnforderung Anforderung
erfüllt
(ankreuzen,
falls ja)Prüfvermerk
Gemeinsamer
Bundesausschuss„Prüfungsteilnehmer, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben Modul 3 A-Z Kodierung eintragen Abschnitt 3.6 „Anzahl der Prüfungsteilnehmer an den klinischen Prüfungen zu dem Arzneimittel, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben“ ist ausgefüllt; ☐ im Abschnitt 3.6.1 „Referenzliste für Abschnitt 3.6“ ist eine Referenzliste der in Abschnitt 3.6 zitierten Literatur enthalten ☐ Modul 5
(Anlagen)Die Anlagen zu Modul 3 A-Z Kodierung eintragen enthalten folgende Dokumente:
Volltexte für alle in der Referenzliste für Abschnitt 3.6 genannten Literaturzitate☐ SAS-Auszüge zur Zusammenfassung der Studienrekrutierung nach Land und Prüfstelle je Studie ☐“ - 6.
-
Die Anlage II.5 „Modul 3 – Zweckmäßige Vergleichstherapie, Anzahl der Patienten mit therapeutisch bedeutsamem Zusatznutzen, Kosten der Therapie für die GKV, Anforderungen an eine qualitätsgesicherte Anwendung“ wird wie folgt geändert:
- a)
-
Dem Titel der Anlage II.5 „Modul 3 – Zweckmäßige Vergleichstherapie, Anzahl der Patienten mit therapeutisch bedeutsamem Zusatznutzen, Kosten der Therapie für die GKV, Anforderungen an eine qualitätsgesicherte Anwendung“ werden ein Komma und die Wörter „Prüfungsteilnehmer im Geltungsbereich des SGB V“ angefügt.
- b)
-
Dem Tabellenverzeichnis werden die Angaben „Tabelle 3-11: Angaben zur Anzahl der Prüfungsteilnehmer in zulassungsrelevanten und im Rahmen dieses Dossiers vorgelegten Studien zu dem zu bewertenden Arzneimittel in dem zu bewertenden Anwendungsgebiet“ angefügt.
- c)
-
In Abschnitt 3 „Modul 3 – allgemeine Informationen“ werden in der Aufzählung nach der Angabe „(Abschnitt 3.4)“ folgende Angaben eingefügt:
- „–
-
Angaben zur Prüfung der Erforderlichkeit einer Anpassung des einheitlichen Bewertungsmaßstabes für ärztliche Leistungen (EBM) (Abschnitt 3.5)
- –
-
Angaben zur Anzahl der Prüfungsteilnehmer an den klinischen Prüfungen zu dem Arzneimittel, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben (Abschnitt 3.6)“.
- d)
-
Dem Abschnitt 3.5 wird folgender neuer Abschnitt 3.6 „Angaben zur Anzahl der Prüfungsteilnehmer an den klinischen Prüfungen zu dem Arzneimittel, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben“ angefügt:
„3.6 Angaben zur Anzahl der Prüfungsteilnehmer an den klinischen Prüfungen zu dem Arzneimittel, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben
Für ab 1. Januar 2025 in Verkehr gebrachte Arzneimittel ist die Anzahl der Prüfungsteilnehmer an klinischen Prüfungen zu dem zu bewertenden Arzneimittel in dem zu bewertenden Anwendungsgebiet, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben, und die Gesamtzahl der Prüfungsteilnehmer anzugeben.
Die Angaben dienen der Feststellung, ob die klinischen Prüfungen des zu bewertenden Arzneimittels in dem zu bewertenden Anwendungsgebiet zu einem relevanten Anteil im Geltungsbereich des SGB V durchgeführt wurden. Das ist der Fall, wenn der Anteil der Prüfungsteilnehmer an den klinischen Prüfungen des zu bewertenden Arzneimittels in dem zu bewertenden Anwendungsgebiet, die an Prüfstellen im Geltungsbereich des SGB V teilgenommen haben, an der Gesamtzahl der Prüfungsteilnehmer mindestens fünf Prozent beträgt.
Es sind alle Studien, welche nach § 35a Absatz 1 Satz 3 SGB V in Verbindung mit § 4 Absatz 6 AM-NutzenV als Teil des Nutzenbewertungsdossiers in dem zu bewertenden Anwendungsgebiet übermittelt werden, aufzuführen. Es sind solche Studien zu berücksichtigen, die ganz oder teilweise innerhalb des in diesem Dokument beschriebenen Anwendungsgebiets durchgeführt wurden. Bezüglich der Zulassungsstudien werden alle Studien einbezogen, welche der Zulassungsbehörde im Zulassungsdossier für die Beurteilung der klinischen Wirksamkeit und Sicherheit des Arzneimittels in dem zu bewertenden Anwendungsgebiet übermittelt wurden.
Einzubeziehen in die Ermittlung sind ausschließlich klinische Prüfungen, wie sie in Artikel 2 Absatz 2 Nummer 2 der Verordnung (EU) Nr. 536/2014 des Europäischen Parlaments und des Rates vom 16. April 2014 über klinische Prüfungen mit Humanarzneimitteln und zur Aufhebung der Richtlinie 2001/20/EG (ABl. L 158 vom 27.5.2014, Satz 1) definiert werden. Sonstige, nichtinterventionelle klinische Studien wie etwa Anwendungsbeobachtungen sind nicht zu berücksichtigen.
Zudem sind nur klinischen Prüfungen einzubeziehen, die in einem Studienregister/einer Studienergebnisdatenbank registriert worden sind und bei denen die Rekrutierung der Studienteilnehmer abgeschlossen ist (last patient in (LPI) beziehungsweise last patient first visit (LPFV)).
Listen Sie in der nachfolgenden Tabelle 3-11 alle im Rahmen dieses Dossiers (Modul 4, Abschnitt 4.3.1.1.1, 4.3.2.1.1, 4.3.2.2.1, 4.3.2.3.1) vorgelegten Studien zu dem zu bewertenden Arzneimittel in dem zu bewertenden Anwendungsgebiet sowie alle Studien, welche der Zulassungsbehörde im Zulassungsdossier für die Beurteilung der klinischen Wirksamkeit und Sicherheit des Arzneimittels in dem zu bewertenden Anwendungsgebiet übermittelt wurden. Jede Studie ist nur einmal einzubeziehen. Fügen Sie für jede Studie eine neue Zeile ein und nummerieren Sie die Studien fortlaufend. Setzen Sie die Anzahl der Teilnehmer an deutschen Prüfstellen und die Gesamtzahl der Prüfungsteilnehmer in den klinischen Studien über alle Prüfstellen hinweg ins Verhältnis. Geben Sie zu den herangezogenen Studien den Studienregistereintrag und den Status (abgeschlossen/laufend) an. Geben Sie bei laufenden Studien das Datum an, an dem der letzte Patient eingeschlossen wurde (LPI/LPFV). Hinterlegen Sie als Quelle zu den herangezogenen Patientenzahlen den zugehörigen SAS-Auszug zur Zusammenfassung der Rekrutierung nach Land und Prüfstelle.
Tabelle 3-11: Angaben zur Anzahl der Prüfungsteilnehmer in zulassungsrelevanten und im Rahmen dieses Dossiers vorgelegten Studien zu dem zu bewertenden Arzneimittel in dem zu bewertenden Anwendungsgebiet
Nummer Studientitel Name des Studien-
registers/
der Studienergebnis-
datenbank und Angabe der ZitateaStatus Bei laufen-
den Studien:
Datum
LPI/LPFVZulassungs-
studie
[ja/nein]Quelle
SAS-AuszugAnzahl der
Prüfungs-
teilnehmer über alle
PrüfstellenAnzahl der Prüfungs-
teilnehmer
an deutschen
Prüfstellen<Studie 1> <Studie 2> Gesamt In Prozent (%) a Zitat des Studienregistereintrags sowie die Studienregisternummer (NCT-Nummer, CTIS-Nummer) 3.6.1 Referenzliste für Abschnitt 3.6
Listen Sie nachfolgend alle Quellen (zum Beispiel EPAR, Publikationen), die Sie im Abschnitt 3.6 angegeben haben (als fortlaufend nummerierte Liste). Verwenden Sie hierzu einen allgemein gebräuchlichen Zitierstil (zum Beispiel Vancouver oder Harvard). Sämtliche Quellen sind im Volltext beizufügen.
<< Angaben des pharmazeutischen Unternehmers >>“
Die Änderung der Verfahrensordnung tritt am Tag nach der Veröffentlichung im Bundesanzeiger in Kraft.
Die Tragenden Gründe zu diesem Beschluss werden auf den Internetseiten des Gemeinsamen Bundesausschusses unter www.g-ba.de veröffentlicht.
Gemeinsamer Bundesausschuss
gemäß § 91 SGB V
Der Vorsitzende
Prof. Hecken











Kommentar hinterlassen