Bundesinstitut
für Arzneimittel und Medizinprodukte
Bekanntmachung
einer Mitteilung
zum Homöopathischen Arzneibuch
(Empfehlungen der Fachausschüsse der
Deutschen Homöopathischen Arzneibuch-Kommission)
Auf Grund des § 8 Absatz 5 der Gemeinsamen Geschäftsordnung der Deutschen Arzneibuch-Kommission und der Deutschen Homöopathischen Arzneibuch-Kommission sowie ihrer Gremien vom 1. Oktober 2025 sind Empfehlungen der Fachausschüsse der Deutschen Homöopathischen Arzneibuch-Kommission den obersten Landesgesundheits- und Landesveterinärbehörden sowie den betroffenen Fach- und Wirtschaftskreisen zur Kenntnis zu bringen.
Der Fachausschuss Analytik der Deutschen Homöopathischen Arzneibuch-Kommission hat den unten genannten Entwurf einer revidierten Monografie für die Aufnahme in das Homöopathische Arzneibuch empfohlen. Dieser wird hiermit zur Kenntnis gebracht (Anlage).
Artemisia absinthium ex herba siccata, ethanol. Infusum
(Absinthium, ethanol. Infusum)
Stellungnahmen zu dem oben genannten Entwurf des Homöopathischen Arzneibuches sind
bis spätestens 1. Februar 2026 einschließlich
an die Geschäftsstelle der Arzneibuch-Kommissionen im Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, zu richten.
31.22-2025-39419
Bundesinstitut
für Arzneimittel und Medizinprodukte
In Vertretung
Prof. Dr. Knöß
Anmerkung zur Monografie:
Aufgrund eines Fehlers in der Formel für die Berechnung des Gehalts wird die Monografie erneut angehört.
Artemisia absinthium ex herba siccata, ethanol. Infusum
Absinthium, ethanol. Infusum
Verwendet werden die getrockneten oberen Sprossteile und Laubblätter oder die getrockneten basalen Laubblätter von Artemisia absinthium L. zur Blütezeit allein oder in Mischung. 1 kg Droge enthält mindestens 2 ml ätherisches Öl.
Eigenschaften, Prüfung auf Identität, Prüfung auf Reinheit, Gehaltsbestimmung
Die Droge muss der Monographie Wermutkraut (Ph. Eur.) entsprechen.
Arzneiformen
Die Urtinktur hat einen Bitterwert von mindestens 1500.
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 20 mit Ethanol 43 % (m/m)
Eigenschaften
Die Urtinktur ist eine gelb- bis dunkelbraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 10 ml Urtinktur werden unter vermindertem Druck bei höchstens 35 °C auf etwa 7 ml eingeengt. Der Rückstand wird dreimal mit je 5 ml einer Mischung von 7 Volumteilen Ethylacetat R und 93 Volumteilen Toluol R ausgeschüttelt. Die vereinigten organischen Phasen werden unter vermindertem Druck zur Trockne eingedampft.
Der Rückstand wird in 1 ml Methanol R aufgenommen.
Referenzlösung: 2 mg Resorcin R und 2 mg Methylrot R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 µm) [oder DC-Platte mit Kieselgel R (2 bis 10 µm)]
Fließmittel: Aceton R, wasserfreie Essigsäure R, Toluol R (10:10:80 V/V/V)
Trocknen: im Kaltluftstrom
Auftragen: 60 µl [oder 16 µl] Untersuchungslösung und 20 µl [oder 12 µl] Referenzlösung; bandförmig 20 mm [oder 8 mm]
Laufstrecke: 15 cm [oder 7 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Acetanhydrid-Schwefelsäure-Reagenz RH behandelt und 5 bis 10 min lang bei 105 bis 110 °C erhitzt.
Die Auswertung erfolgt innerhalb von 10 min im Tageslicht.
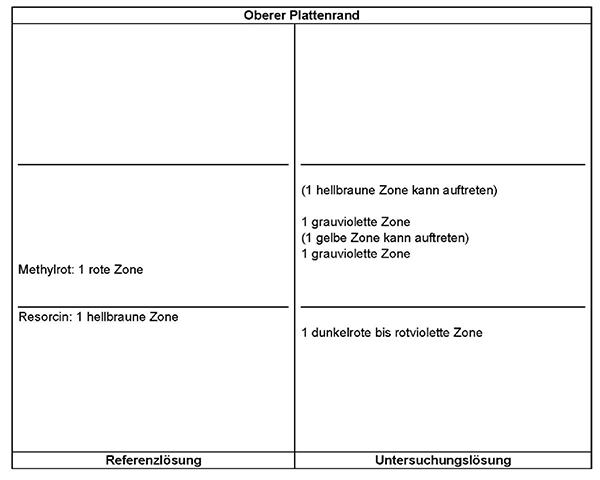
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich.
Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,930 bis 0,945
Trockenrückstand (H 2.2.6): mindestens 1,4 Prozent
Wertbestimmung
Bitterwert (2.8.15): mindestens 1 500, mit einer Verdünnung der Urtinktur bestimmt
Gesamt-Thujon:
Gaschromatographie (2.2.28): höchstens 0,02 Prozent berechnet als α-Thujon
Interner-Standard-Lösung: 100,0 mg Car-3-en R werden in Ethanol 96 % R zu 100,0 ml gelöst.
Untersuchungslösung: 5,00 g Urtinktur werden mit 1,0 ml Interner-Standard-Lösung versetzt und mit Ethanol 96 % R zu 10,0 ml verdünnt und über einen Membranfilter (nominale Porengröße 0,45 µm) filtriert.
Referenzlösung: 10,0 mg (−)-α-Thujon RH werden in Ethanol 96 % R zu 20,0 ml gelöst.
1,0 ml Lösung und 1,0 ml Interner-Standard-Lösung werden mit Ethanol 96 % R zu 10,0 ml verdünnt.
Säule
- –
-
Material: Quarzglas
- –
-
Größe: l = 30 m, ∅ = 0,25 mm
- –
-
Stationäre Phase: Polydimethylsiloxan R (Filmdicke 0,25 µm)
Trägergas: Helium zur Chromatographie R
Durchflussrate: 1,0 ml · min−1
Splitverhältnis: 1:25
Temperatur
| Zeit (min) |
Temperatur (°C) |
|
|---|---|---|
| Säule | 0 – 10 | 80 |
| 10 – 15 | 80 – 100 | |
| 15 – 16 | 100 | |
| 16 – 21 | 100 – 240 | |
| 21 – 31 | 240 | |
| Probeneinlass | 250 | |
| Detektor | 250 |
Detektion: Flammenionisation
Einspritzen: 1 µl
Relative Retention (bezogen auf α-Thujon, tR etwa 10 min)
- –
-
Car-3-en: etwa 0,65
- –
-
β-Thujon: etwa 1,05
Eignungsprüfung
- –
-
Wiederholpräzision: höchstens 2,0 Prozent relative Standardabweichung für das Flächenverhältnis des α-Thujon-Peaks zum Peak des internen Standards nach 6-maligem Einspritzen der Referenzlösung
Der Prozentgehalt (m/m) an Gesamt-Thujon (die Summe von α- und β-Thujon), berechnet als α-Thujon, wird nach folgender Formel berechnet:
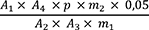
| A 1 | = | Summe der Flächen der α- und β-Thujon-Peaks im Chromatogramm der Untersuchungslösung |
| A 2 | = | Fläche des α-Thujon-Peaks im Chromatogramm der Referenzlösung |
| A 3 | = | Fläche des Car-3-en-Peaks im Chromatogramm der Untersuchungslösung |
| A 4 | = | Fläche des Car-3-Peaks im Chromatogramm der Referenzlösung |
| m 1 | = | Einwaage der Urtinktur in Gramm |
| m 2 | = | Masse der Referenzsubstanz (−)-α-Thujon RH in Gramm |
| p | = | Prozentgehalt an α-Thujon in der Referenzsubstanz (−)-α-Thujon RH |











Kommentar hinterlassen